米老排子叶节再生体系的建立
杨贺月,郑明扬,杨恩点,杨智添,张俊杰*(华南农业大学林学与风景园林学院,广东广州510642)
摘要:米老排是优良的速生树种,是油脂和饲料的来源,具有重要的商业价值。以米老排种子为材料,筛选最佳灭菌方式,再以无菌苗**子叶节**为外植体,研究培养基中的**植物生长调节剂**组合、外植体的苗龄、切割方式和**光质**对子叶节**不定芽诱导**的影响。结果表明,种子最优消毒方式为**75%乙醇1min+7.5%次氯酸钠15min**,此时污染率为10.00%,萌发率为86.67%;以无菌苗子叶节为外植体,在MS基础培养基中添加**6.0mg/L6-BA+0.5mg/LIBA**不定芽再生效果最佳,子叶节不定芽诱导率为**100%**,平均每个外植体产生4.67个不定芽。此外,苗龄的增加、切割方式和光质的改变都是影响不定芽诱导的因素。最佳**生根方式**为在MS基础培养基中添加**0.1mg/LIBA**,不定芽生根率最高,达77.78%、生根系数为3.94,炼苗移栽成活率在85%以上。该结果可为米老排的**遗传转化**、转基因和良木遗传育种的研究提供技术参考。
关键词: 米老排; 子叶节; 不定芽诱导; 植物组织培养; 6-BA; IBA
**米老排**(**Mytilarialaosensis**)别名壳菜果,是一种常绿阔叶乔木。主要分布于中国广东、广西等地,是优良的**速生用材树种**[1]。米老排树干生物量大[2-4],材性优良,成材较早,适于制作家具和胶合板等[5-6]。而且米老排叶片肥大嫩绿,含有16种氨基酸,富含粗纤维、粗蛋白和维生素等,是一种具有发展潜力的**木本饲料**。另外,米老排还具有保持水土、涵养水源、改善土壤理化性质和做防火林带等**生态功能特性**。
目前,米老排以种子实生苗繁育为主,不但需要较长时间,而且受季节限制。关于米老排组织培养,目前仅有茎段快繁一种方式[9-11],茎段快繁污染率和褐化率较高,存活率较低,体系不稳定。采用米老排无菌实生苗的**子叶节**作为外植体,取材方便,不受季节和天气影响,能克服污染率和褐化率高的问题,且子叶节**再生潜力大**,以此构建一套稳定的再生体系,可为促进米老排**无性系林业发展**提供技术支撑。
本研究以米老排无菌实生苗子叶节为外植体,研究**植物生长调节剂**、**苗龄**、**切割方式**和**光质**等因素对**不定芽诱导**的影响,接着探究不定芽最适的生根培养基配方,并对再生植株进行炼苗移栽,旨在建立一套**高效、稳定的米老排不定芽再生体系**,为米老排的无性繁殖和遗传转化提供技术支持。
1材料和方法
1.1 试验材料和培养条件
米老排种子采于广东省韶关市乐昌林场。本试验中均用**MS培养基**且附加30g/L蔗糖和6g/L琼脂,用NaOH或HCl将试验中所有培养基pH调至5.8~6.0,并进行高压灭菌20min(12℃,0.1MPa)。试验材料都放置在无菌组培室内培养,组培室为冷白光(2500Lx),光照时间为12h/d,温度为25C,湿度在70%左右。
1.2 种子灭菌方式探索
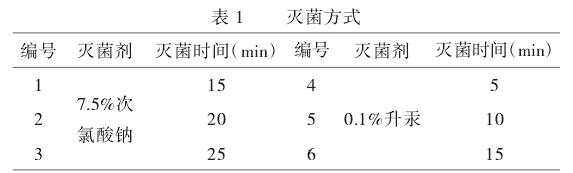
将米老排种子去除外壳,用洗洁精浸泡2min,流水下冲洗30min,在超净工作台上用75%乙醇灭菌1min,无菌水洗3次,接着用6种灭菌方式分别处理种子(如表1),最后用无菌水摇晃清洗多次。播种于无激素培养基中,每瓶1个种子,每种灭菌方式60瓶。
1.3 植物激素对不定芽诱导的影响
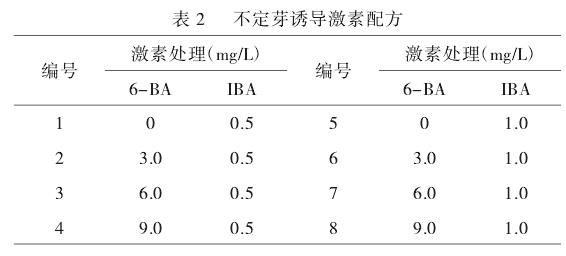
米老排播种30d后,无菌苗长出第1片真叶时,取无菌苗的**子叶节**作为外植体(图1a),接入不同配方的8种培养基中,在最优培养基的基础上考察培养条件对子叶节不定芽的影响(如表2),每组处理接种15个外植体。

1.4 苗龄、切割方式和光质等培养条件对不定芽诱导的影响
在筛选出子叶节不定芽诱导的最优激素组合的培养基上,对培养条件考察,考察**苗龄**、**切割方式**和**光质**对子叶节不定芽诱导的影响(如表2),每组处理接种15个外植体。
1.5 组培苗的生根培养

当不定芽长至2cm左右时,将其切下,接种到含有不同种类生长素和浓度的MS培养基中(如表3)。每个处理接种15个外植体。
1.6 炼苗移栽
选取生根良好的再生苗,将其培养瓶的瓶盖拧松,加入纯净水,在组培室**炼苗**3d左右,将幼苗移栽到湿润的无菌基质(W泥炭土︰W珍珠岩=3︰1)中,盖上透明塑料盖。完成移栽后将幼苗放在温度25C,光照强度为2500Lx的温室中。观察小苗2~3周,待长出新叶,标志着再生苗已经**移栽成活**。
1.7 数据统计
所有数据的平均值和标准误差使用SPSS23.0软件对数据进行**差异显著性分析**,差异显著性水平$P$值$<0.05$为显著性。
2结果与分析
2.1 不同灭菌方式对米老排种子的影响
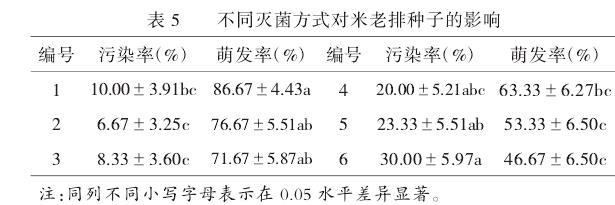
由表5可知,播种10d后,使用**次氯酸钠灭菌效果优于升汞**。次氯酸钠处理15min时萌发率最高,为**86.67%**;而升汞处理种子5min时萌发率最高,为63.33%,并且随着升汞灭菌时间的延长污染率上升,萌发率降低。米老排种子最佳灭菌方式为**7.5%次氯酸钠处理15min**。
2.2 植物生长调节剂对不定芽诱导的影响
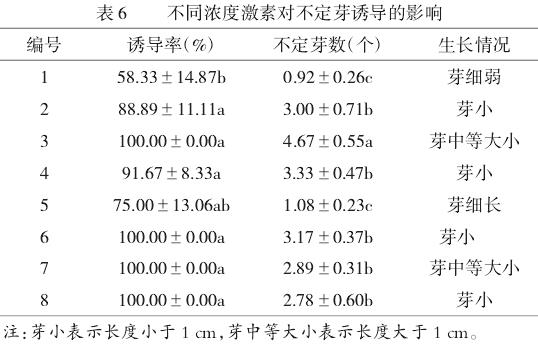
由表6可知,接种50d后,当生长素IBA为0.5mg/L或1.0mg/L时,诱导率和不定芽数随6-BA浓度的升高呈现**先增加后降低的趋势**;3号培养基诱导率最高、不定芽数最多、生长状态最好;综合诱导率、不定芽数和长势,在**6-BA为6.0mg/L、IBA为0.5mg/L**时为最优诱导不定芽的培养基配方,其不定芽的诱导率和不定芽数分别为**100%**和**4.67个**,不定芽健壮,叶片舒展(图1b)。
2.3 苗龄、切割方式和光质等培养条件对不定芽诱导的影响
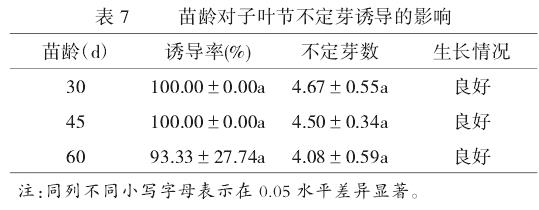
2.3.1 外植体年龄对不定芽诱导的影响。
由表7可知,接种50d后,诱导率和不定芽数随苗龄的增加表现出**降低的趋势**,诱导率和不定芽数最高的为1号30d苗龄的子叶节。综合来看,运用1号**30d苗龄**的子叶节为最佳。
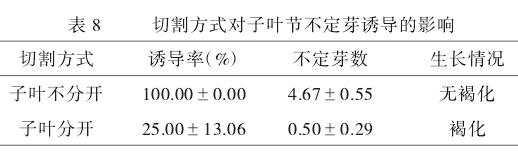
2.3.2 不同切割方式对子叶节不定芽诱导的影响。
由表8可知,切割方式对子叶节不定芽诱导的影响很大。1号的诱导率为100.00%,平均芽数为4.67,而2号的诱导率为25.00%,平均芽数0.50个,并且生长褐化。说明**子叶不分离**能在一定程度上提高子叶节外植体的诱导效率.因此,子叶不分离去除顶芽,切除子叶的2/3是米老排子叶节不定芽诱导的**最佳操作**。
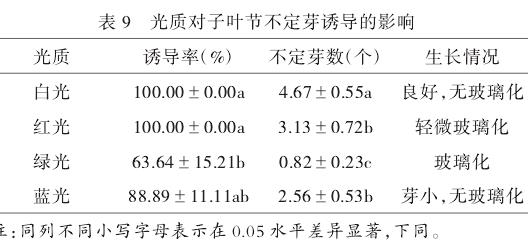
2.3.3 光质对子叶节不定芽诱导的影响。
由表9可知,接种50d后,4种光质诱导率和不定芽数差异显著,诱导率和不定芽数表现出一样的趋势,从多到少依次为**白光>红光>蓝光>绿光**;外植体对3号绿光的反应最差,其诱导率和不定芽数分别为63.64%和0.82,且表现出**玻璃化现象**。综合来看,外植体在1号**白光**诱导下表现最佳状态。
2.4 激素对不定芽生根的影响
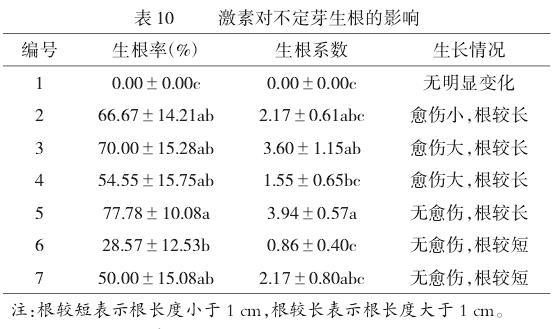
由表10可知,接种40d后,1号培养基生长素为0时,生根率和平均根数也为0。2、3、4号添加了NAA生长素后,生根率随着NAA浓度的增加呈先升后降的趋势。5、6、7号添加IBA后的培养剂生根率和生根系数表现出高低高的趋势,在5号用量为**0.1mg/LIBA**时达到最大值,生根率、生根系数分别为**77.78%**、**3.94**,并且**无愈伤**,根系较长(图2a)。

2.5 炼苗与移栽
移栽1个月后**成活率在85%以上**,并且植株生长健康(图2b)。
3结论与讨论
3.1 消毒方式和时间对种子污染和萌发的影响
本研究发现,**次氯酸钠**灭菌处理米老排种子的效果**优于升汞溶液**,可能是因为米老排种壳特别坚硬且在去除外种皮时容易损伤内种皮,升汞毒性大,易造成种胚毒害难以发芽[12, 14]。因此,本试验以**7.5%次氯酸钠灭菌15min**的效果最佳。
3.2 植物生长调节剂对不定芽的影响
本试验中**6-BA**的使用浓度对不定芽具有重要影响,其浓度在6.0mg/L时效果最佳。说明在米老排子叶节直接诱导不定芽发生过程中,培养基中添加**细胞分裂素6-BA**占据主导作用是诱导不定芽产生的关键[15]。本试验最佳浓度为**6.0mg/L6-BA**,诱导出的不定芽染色体是否加倍,需要进一步验证。
3.3 苗龄、切割方式和光质等培养条件对不定芽诱导的影响
3.3.1 苗龄对不定芽诱导的影响
本试验结果表明,**30d苗龄**子叶节的诱导效果强于45d和60d,并且发现诱导率和不定芽系数随着苗龄的增加而下降,可能是苗龄小的外植体有着更活跃的分化细胞和更强的再生能力[17-18]。
3.3.2 切割方式对不定芽诱导的影响。
子叶节的不同切割处理方式对不定芽增殖系数有很大的影响。本试验中,子叶分开方式的切割处理,发现外植体褐化不能正常生长,而**子叶不分开**的方式生长情况较好。可能是因为外植体幼嫩且较短,内含致褐物质较高[21],并且2片子叶分开时产生的切割创伤面与体积太大造成的外植体褐化[22]。因此,本试验对外植体的最佳切割方式为子叶不分开去除顶芽,切除子叶的2/3,与郑宝仁等[19]的研究相似。
3.3.3 光质对子叶节不定芽诱导的影响。
本研究中,对比组培室的**白光**,各处理红、绿、和蓝光都**抑制了**米老排子叶节不定芽的再生效率。尤其是**绿光**影响下其诱导率和平均不定芽数达到最低值,且表现出**玻璃化状态**。米老排子叶节诱导的不定芽个数对白光表现出较好的效果、对绿光表现出抑制的现象,这与张小芳[24]和苏恒[25]的研究相一致。
3.4 生长素对不定芽生根的影响
本试验中植物激素的添加对不定芽生根效果有很大的影响,单独添加IBA、NAA均能诱导米老排组培苗不定根的产生,但添加**IBA明显好于添加NAA的生根效果**。在生根培养基中添加NAA,外植体基部首先长出愈伤组织,这样的根较细、长势弱。而在培养基中添加生长素IBA,无愈伤组织产生,根系直接从外植体基部长出,且诱导出的根粗壮、长势强,这与王世鹏等[13]、陈娜[26]等、陈春利等[27]、王婧宇等[28]的研究有相似的结论。(收稿:2024-03-29)


