艾纳香盆栽的干旱胁迫试验 怎么样 图片
访问量:131
1 材料与方法
1.1 试验材料
同一生长水平的一年生艾纳香幼苗采自贵州省罗甸县逢亭镇逢亭村。试验在贵州大学进行,提前准备花盆与土壤。
(1) 土壤前处理:把准备好的土壤充分拌匀(试验地土壤及盆栽用土均由石灰岩发育而来,呈微碱性,肥力中等),用多菌灵对土壤进行消毒,覆膜杀菌 2 d,之后去膜至少晾晒 7 d。土壤的田间持水量 FC 为 31.81%,土壤含水量 Cs 为 11.58%(烘干法测定),盆重 PZ 为 0.15 kg。
(2) 幼苗移栽处理:控制移栽时装入盆中土壤的重量 (TZ, 4.50 kg,约距花盆沿 2~3 cm),每盆编号,做好记录,移栽之后进行统一的水肥管理。至 2014 年 5 月 1 日,选取长势良好、较为一致的无病虫害艾纳香盆栽苗作为干旱胁迫试验材料,移入隔绝降水的透明大棚。此时盆中苗木平均质量 MZ 约 0.05 kg。

1.2 干旱胁迫试验设计
艾纳香为多年生草本植物,不耐寒,故选择6—9 月于贵州大学林学院苗圃大棚 (防止降水对试验的影响) 内进行试验。依据 2013 年暑假进行的预实验结果,设置 4 个土壤含水量梯度:田间持水量的 80% (对照,CK)、60% (轻度胁迫,LD)、40% (中度胁迫,MD)、30% (重度胁迫,SD),每个处理做 3 个重复,每个重复 12 盆,胁迫时间从 6 月 1 日—9 月 15 日,期间不施肥随时除杂草,分别于试验前期 (6 月中旬)、中期 (8 月初)、后期 (9 月中旬) 取样 (取样间隔大约为 15 d)。
其中,水分梯度通过盆栽称重法控制总重量 (ZZ),公式为 ZZ=PZ+MZ+TZ/(1+Cs)×(1+RECs×FC)。式中,RWCs 为土壤相对含水量,意为土壤含水量与该土壤田间持水量的百分比;Cs 为土壤含水量;FC 为田间持水量。
计算 CK、LD、MD 和 SD处 理 组 的 盆 栽 苗 控 制 总 质 量 分 别 为 : 5.266、4.974、4.682 和 4.536 kg,并根据植株长势情况适当增减控制重量。前期每天下午 5:00—6:00称重并对水分状况进行调整 (电子秤,感量 5 g),至 6 月 1 日各个处理组均达到设定的水分条件进行试验。
其中,水分梯度通过盆栽称重法控制总重量 (ZZ),公式为 ZZ=PZ+MZ+TZ/(1+Cs)×(1+RECs×FC)。式中,RWCs 为土壤相对含水量,意为土壤含水量与该土壤田间持水量的百分比;Cs 为土壤含水量;FC 为田间持水量。
计算 CK、LD、MD 和 SD处 理 组 的 盆 栽 苗 控 制 总 质 量 分 别 为 : 5.266、4.974、4.682 和 4.536 kg,并根据植株长势情况适当增减控制重量。前期每天下午 5:00—6:00称重并对水分状况进行调整 (电子秤,感量 5 g),至 6 月 1 日各个处理组均达到设定的水分条件进行试验。
1.3 各项指标的测定方法
(1) 植物形态与生物量
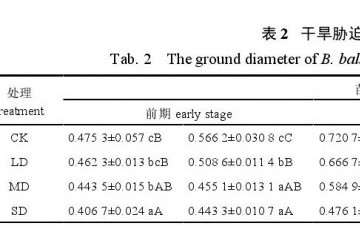
每个处理随机抽取 10 株,利用卷尺和游标卡尺测定苗木的苗高、地径。
每次试验结束后将不同水分处理的苗木各取3 株为 3 个重复,用自来水冲去植物根部所带的土壤,将地上部分的茎、叶和地下部分的根分别置于牛皮纸袋中,放入 105 ℃ 的烘箱中杀青 20 min,然后维持在 85 ℃,烘干至恒重,称取三者总重量为艾纳香生物量,地下部分根干重与地上部分茎和叶干重的比值为根冠比。

(2) 叶片显微结构
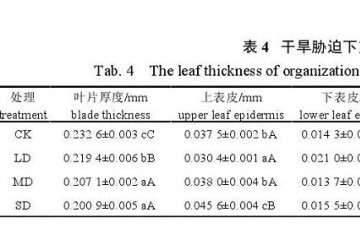
每个处理随机选取 3 株植物,选取中部成熟叶片,用清水冲洗干净,滤纸吸干后放入 70%的 FAA 固定液内保存。将事先固定好的叶片材料选取叶片中部切为 0.5 cm 长宽的小块,进行石蜡切片,步骤为:取材与固定→洗涤→脱水与硬化→脱酒精→埋蜡→切片与粘片→脱蜡→染色→封片和镜检。采用 BM2000 型生物显微镜观察,并采用 JIFEI TECH 图像软件进行拍照和显微测量。主要测量叶片厚度、上表皮厚度、下表皮厚度、栅栏组织厚度、海绵组织厚度、叶脉周长、叶脉面积、维管束面积,并计算维管束面积与叶面积比值。
细胞结构紧密度 (cell tense ratio,CTR) 和细胞结构疏松度 (spongy ratio,SR),计算公式[18]为CTR=栅栏组织厚度/叶片厚度×100%;SR=海绵组织厚度/叶片厚度×100%